Temperatuur kan worden verklaard uit de warmtebeweging van en in de moleculen van een stof. Hoe warmer een stof is, des te meer de moleculen bewegen, draaien, of trillen. Temperatuur kan zo worden beschouwd als een maat van de gemiddelde kinetische energie (bewegingsenergie) per molecuul.
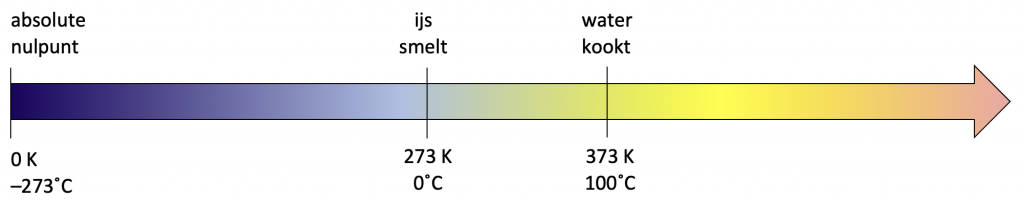
Het is denkbaar dat een stof zo koud wordt, dat de moleculen stil komen te staan. Zij hebben dan geen kinetische energie meer. Deze koudst mogelijke temperatuur wordt het absolute nulpunt genoemd. Op de Celsiusschaal ligt dit absolute nulpunt op –273˚C.
Wetenschappers gebruiken vaak een temperatuurschaal waarbij aan het absolute nulpunt de waarde nul wordt toegekend. Dit heet absolute temperatuur. De SI-eenheid voor absolute temperatuur is de kelvin (K):
(temperatuur in K) = (temperatuur in ˚C) + 273.
Pas op: voor temperatuurverschillen hebben de kelvin- en Celsiusschaal dezelfde getalswaarde.
Voorbeeld: “Alcohol” (ethanol) heeft een smeltpunt van –114˚C en een kookpunt van 78˚C. Reken deze om naar kelvin.
smeltpunt = –114 + 273 = 159 K;
kookpunt = 78 + 273 = 351 K.
Het temperatuurverschil tussen smeltpunt en kookpunt is
∆T = 78˚C – (–114˚C) = 192 C˚;
∆T = 351 K – 159 K = 192 K.
