De atoomsoorten (of “elementen”) worden meestal systematisch weergegeven in het periodiek systeem. Deze tabel, ontworpen rond 1865 door Dmitri Medeljev, beschrijft overeenkomsten tussen atoomsoorten en helpt bij het bepalen van hun chemisch gedrag.
In het periodiek systeem loopt het atoomgetal op van links naar rechts, dan van boven naar onder.
De rijen in het periodiek systeem heten ook wel perioden. Deze zijn genummerd van 1 tot 7.
De kolommen in het periodiek systeem heten ook wel groepen. Voor de groepen bestaan twee nummeringsmethoden. De oude methode gebruikt Romeinse cijfers en verdeelt de groepen in “A” en “B”; de nieuwe methode nummert ze eenvoudigweg van 1 tot 18.
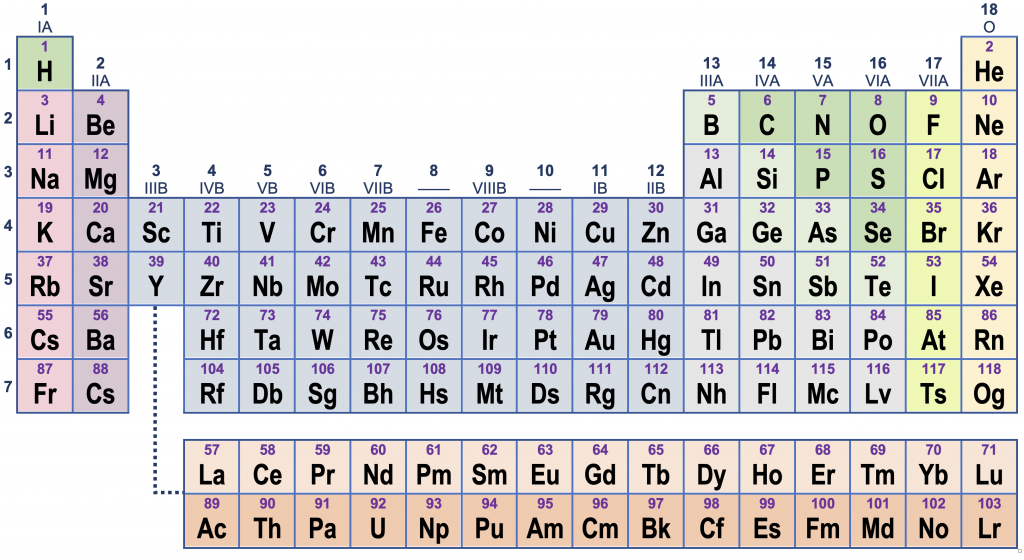
Elementen in dezelfde groep hebben soortgelijk chemisch gedrag. Een duidelijk voorbeeld hiervan is groep 11 (IB). De metalen koper (Cu), zilver (Ag) en goud (Au) zijn kostbare metalen die gebruikt worden voor munten, beeldjes en sierraden. Alle drie hebben een aantrekkelijke metaalglans, roesten niet of nauwelijks, en zijn ongevoelig voor de meeste zuren.
Onderaan het periodiek systeem staan twee stroken met vijftien elementen. De lanthaniden (La tot Lu) horen eigenlijk in periode 6, tussen barium en hafnium. De actiniden (Ac tot Lr) horen eigenlijk in periode 7, na radium. Alle actiniden zijn radioactief.
