Om bovenstaande ideeën te verfijnen, beschouwen wij de elektronegativiteit van de verschillende soortenatomen. Deze waarde beschrijft hoezeer een atoom elektronen aantrekt. Metalen hebben dus een lage elektronegativiteit; niet-metalen hebben een hoge elektronegativiteit. In het algemeen neemt de elektronegativiteit toe van linksonder naar rechtsboven in het periodiek systeem.
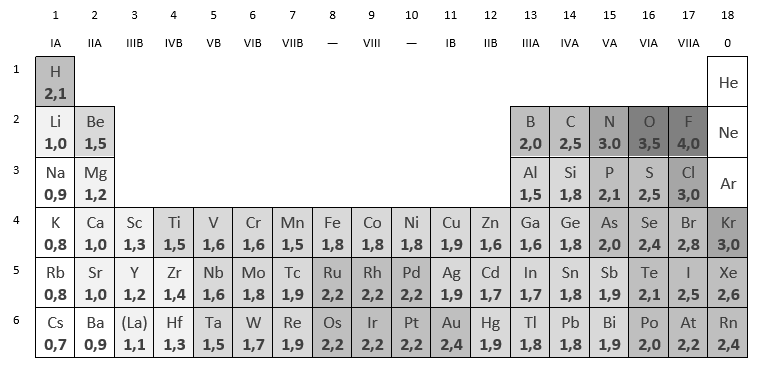
Om te bepalen welk soort binding er gevormd zal worden, bepaalt men het verschil in elektronegativiteit, ∆EN, tussen de twee atomen. (We laten metaalbindingen buiten beschouwing.)
- Als ∆EN ≥ 1,7 kan men een ionbinding Eén of meer elektronen zullen dan worden afgestaan door het minst elektronegatieve element (een metaal) aan het meest elektronegatieve element (een niet-metaal).
- Als ∆EN < 1,7 heeft men een covalente binding. De atomen delen dan één of meer paren elektronen. Men kan verder nog onderscheiden:
- Als ∆EN zeer klein is (≤ 0,4), dan worden de bindingselektronen vrijwel gelijkelijk gedeeld.
- Bij middelmatige waarden van ∆EN (tussen 0,4 en 1,7) spreekt men van een polaire covalente binding. De bindingselektronen bevinden zich relatief dichter bij het meer elektronegatieve atoom dan bij het minder elektronegatieve atoom. Hierdoor krijgen de atomen een gedeeltelijke elektrische lading; dit wordt wel aangegeven met de symbolen δ+ en δ–.
Voorbeelden: Bepaal de soort binding tussen de volgende paren atomen.
- Ca en Br:
∆EN = 2,8 – 1,0 = 1,8. Dit is groter dan 1,7, dus een ionbinding. - O en H:
∆EN = 3,5 – 2,1 = 1,4. Dit is kleiner dan 1,7, maar vrij groot, dus een polaire covalente binding. Het zuurstofatoom heeft een partiële lading δ–; het waterstof atoom δ+.
- C en H:
∆EN = 2,5 – 2,1 = 0,4. Dit is zeer klein, dus een niet-polaire covalente binding.
- Si en Si:
∆EN = 1,8 – 1,8 = 0. Een niet-polaire covalente binding.
