In een waterige oplossing zullen zuren en basen met het omringende water reageren. Dit kan een aflopende reactie zijn of er kan een evenwicht ontstaan, afhankelijk van de sterkte van het zuur of de base.
- sterk zuur: $ \mathrm{HCl + H_2O \rightarrow H_3O^+ + Cl^-}$
- zwak zuur: $ \mathrm{HF + H_2O \rightleftharpoons H_3O^+ + F^-}$ (meestal ligt het evenwicht vrij ver naar links)
- sterke base: $ \mathrm{S^{2-} + H_2O \rightarrow HS^- + OH^-}$
- zwakke base: $ \mathrm{NH_3 + H_2O \rightleftharpoons N_4^+ + OH^-}$ (meestal ligt het evenwicht vrij ver naar links)
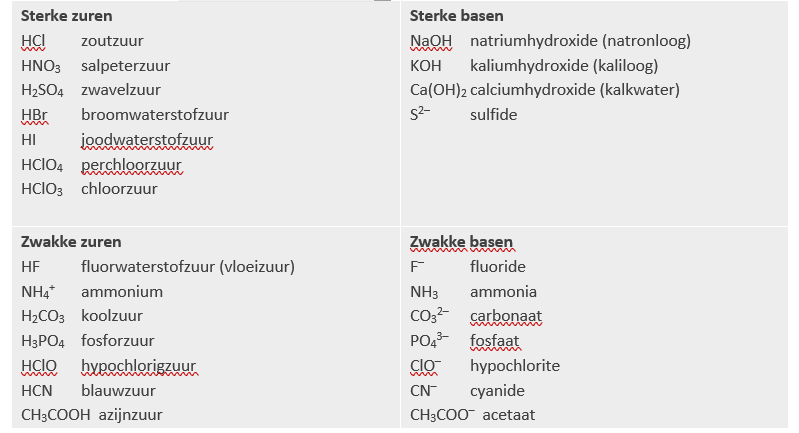
Welke deeltjes (naast H2O) zijn er aanwezig in een oplossing van HNO3?
Omdat HNO3 een sterk zuur is, zal het in principe geheel ionizeren. Dus bevat de oplossing vooral H3O+ en NO3–-ionen.
Welke deeltjes (naast H2O) zijn er aanwezig in een oplossing van HClO in water?
Omdat HClO een zwak zuur is, zal maar een klein deel H+-ionen afstaan. De meeste HClO-moleculen blijven intact.
Terecht schrijft men deze oplossing dan ook als: HClO (aq).Het zuur is in evenwicht met water: $ \mathrm{HCl) + H_2O \rightleftharpoons H_3O^+ + ClO^-}$.
Er zullen dus ook ongeveer gelijke, kleine hoeveelheden H3O+ en ClO– in de oplossing zitten.
Er is ook een zeer kleine hoeveelheid OH– aanwezig, nog minder dan in puur water.
Welke deeltjes (naast H2O) zijn er aanwezig in ammoniak, een oplossing van NH3 in water?
Omdat NH3 een zwakke base is, zal maar een klein deel H+-ionen opnemen. Verreweg de meeste NH3-moleculen blijven intact.
Een klein deel reageert met water en vormt NH4+ en OH–-ionen.
De hoeveelheid H3O+ in deze oplossing is zeer klein.
