Een buffer is een oplossing waarin een zwak zuur met zijn geconjungeerde zwakke base vermengd is.
Een buffer wordt gebruikt om de pH van een oplossing te stabiliseren. Wanneer kleine hoeveelheden zuur of base worden toegevoegd, of wanneer de oplossing verder verdund wordt, blijft de pH vrijwel onveranderd.
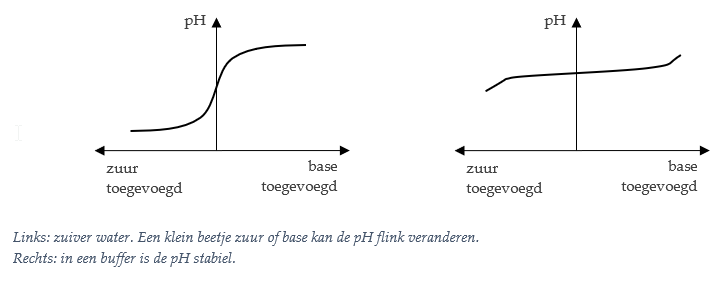
Om de bufferwerking te begrijpen, moet men denken aan het evenwicht tussen het zuur en de base:
$$\mathrm{HX + H_2O \rightleftharpoons X^- + H_3O^+.}$$
Wordt er een ander zuur aan de oplossing toegevoegd, dan stijgt de H3O+-concentratie. Volgens het principe van Le Châtelier zal hierdoor het evenwicht naar de andere kant verschuiven: de meeste H3O+ reageert met de base van de buffer. De toevoeging van H3O+ wordt zo grotendeels ongedaan gemaakt. Een soortgelijke redenering kan worden gegeven voor het toevoegen van een base.
Belangrijke toepassing: In het menselijk lichaam wordt de pH van het bloed vrijwel constant gehouden op 7,4. Een belangrijke bijdrage is de koolzuurbuffer, H2CO3/HCO3–.
