Atomen bestaan uit nog kleinere onderdelen: subatomaire deeltjes.
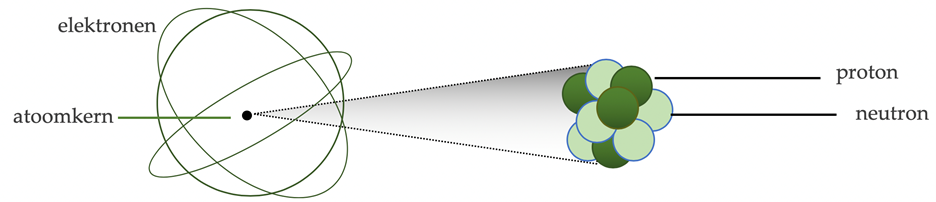
De drie verschillende subatomaire deeltjes zijn het proton, het neutron en het elektron. Zij verschillen in plaatsing, massa en elektrische lading.
| deeltje | plaats | massa | elek. lading | functie |
|---|---|---|---|---|
| proton | atoomkern | ≈ 1 u | + e | trekt de elektronen aan en bepaalt zo indirect de chemische identiteit van het atoom |
| neutron | atoomkern | ≈ 1 u | 0 | houdt de protonen bijeen |
| elektron | banen om de kern heen | ≈ 1/1800 u | –e | de buitenste elektronen zijn betrokken in chemische bindingen en reacties |
u = atomaire massaeenheid, een handige kleine eenheid voor massa; $1 \; \text{u} = 1,66 \cdot 10^{-27} \; \text{kg}.$
e = fundamentele ladingseenheid; $e = 1,6 \cdot 10^{-19} \; \text{C}. $
Doordat de protonen en elektronen tegengestelde elektrische ladingen hebben, trekken zij elkaar aan. Hierdoor blijven de elektronen in banen rond de atoomkern.
De protonen hebben de neiging elkaar af te stoten. Dit gebeurt echter niet, doordat de sterke kernkracht tussen neutronen en protonen dit tegengaat.
