De elektronen in een stabiel atoom bewegen zich in zeer specifieke banen of orbitalen. Elke orbitaal heeft een bepaalde grootte, vorm en energie. Orbitalen maken deel uit van een hiërarchie van schillen (niveaus) en onderschillen (subniveaus).
(Een orbitaal is niet zozeer een “baan” als een “kansverdeling”. Volgens de kwantummechanica kan men niet zeggen dat het elektron zich op één specifieke plek bevindt. In plaats daarvan zijn er plaatsen waar het elektron met grotere of kleinere waarschijnlijkheid te vinden is.) Dat zie je in deze video (Engels):
Van binnenuit naar buiten toe vindt men de volgende orbitalen: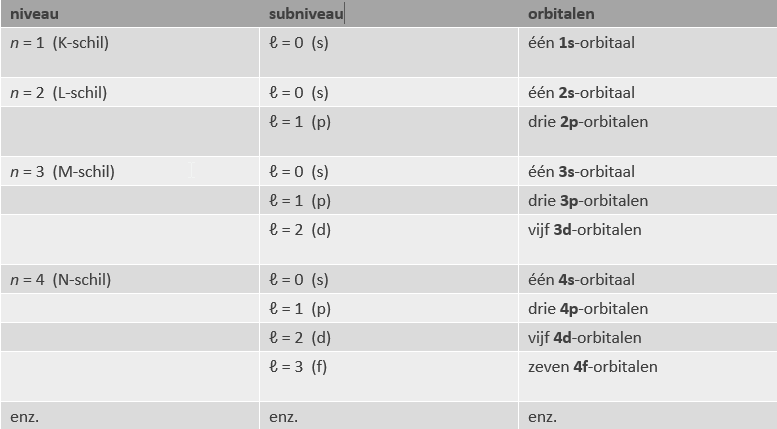
Schillen van hogere niveaus zijn groter, hebben een complexere structuur (meer orbitalen), en kunnen dan ook meer elektronen bevatten.
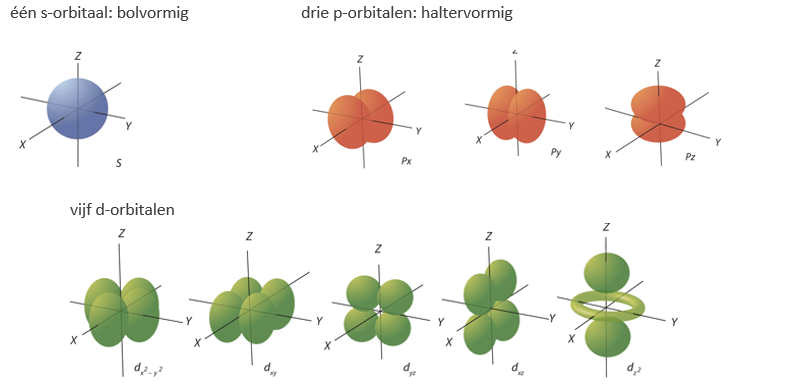
De subniveaus verschillen onderling vooral in de vorm van de orbitalen.
- De ene s-orbitaal is bolvormig.
- De drie p-orbitalen zijn haltervormig en lopen in drie loodrechte richtingen: px, py, pz.
- De vijf d-orbitalen hebben een complexere vorm. Deze kan precies worden berekend met behulp van de kwantummechanica, maar wij hebben deze details hier niet nodig.