Er blijkt een nauw verband te bestaan tussen de elektronenconfiguratie van een atoom en zijn plaats in het periodiek systeem.
- Het nummer van de periode (rij) beschrijft het hoogste hoofdniveau dat elektronen bevat.
- De verschillende verticale blokken in het periodiek systeem komen overeen met de subniveaus (s, p, d, f) waarin de laatste elektronen geplaatst worden.
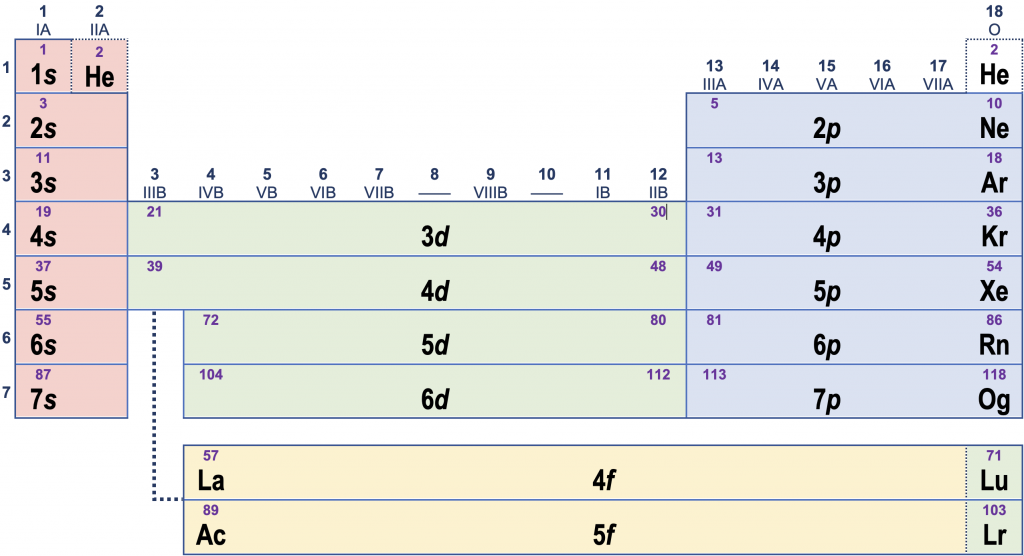
Voorbeeld: Het element antimoon (Sb) heeft elektronenconfiguratie
[Sb] = 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p3 (ofwel [Kr] 5s2 4d10 5p3)
Wij lezen nu meteen af dat antimoon te vinden is in periode 5, aan de rechterkant van het periodiek systeem (het p-blok). Omdat het 5p-subniveau drie elektronen bevat, vindt men antimoon als het derde element in de 5p-strook.
In het bijzonder kan men het aantal valentie-elektronen bepalen aan de hand van het periodiek systeem. Voor neutrale atomen geldt het volgende overzicht. (Let op het afwijkende gedrag van helium.)
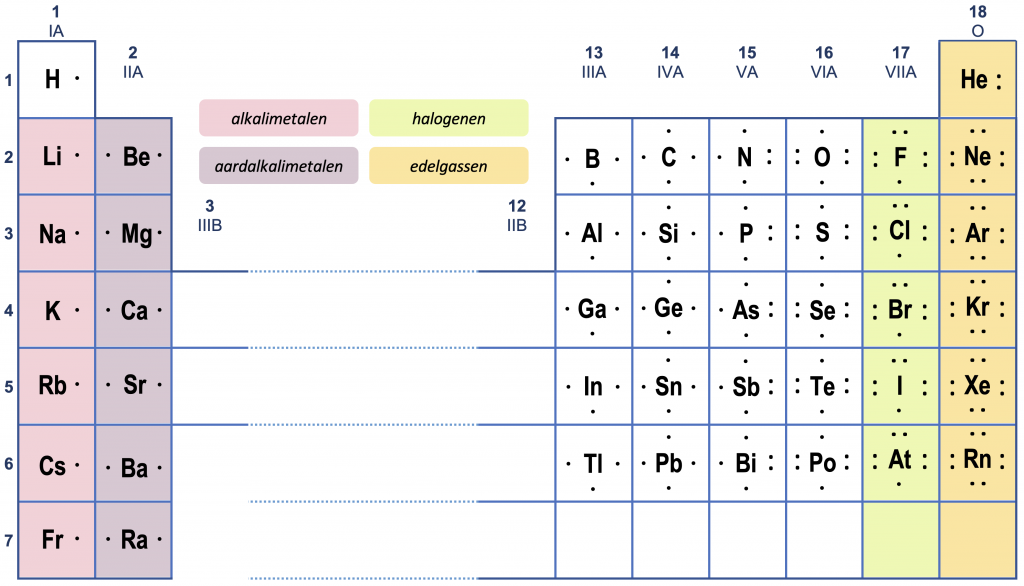
Bij ionen moet men rekeninghouden met het tekort of overschot aan elektronen.
Bepaal de Lewisformules voor Ca2+ en voor N3–.

- Calcium (Ca) bevindt zich in groep 2 (IIA), en heeft dus gewoonlijk twee valentie- elektronen. De lading van het ion is 2+, dus verwijderen wij twee valentie-elektronen. Er blijven er dus nul over.
- Stikstof (N) bevindt zich in groep 15 (VA), en heeft dus gewoonlijk vijf valentie-elektronen. De lading van het ion is 3–, dus voegen wij drie valentie-elektronen toe. Het worden er dus acht.
