In een covalente binding delen twee atomen een elektronenpaar: één valentie-elektron van het ene atoom en één valentie-elektron van het andere atoom. Het elektronenpaar telt nu als behorende bij elk van de atomen. Door een covalente binding te vormen, krijgt een atoom er als het ware een valentie-elektron bij.
Een atoom zal meestal zoveel covalente bindingen vormen als nodig is om aan de octetregel te voldoen. Oftewel,
aantal covalente bindingen = 8 – aantal valentie-elektronen.
(Uitzondering: waterstof vormt slecht één covalente binding.)
Voorbeelden:
- De binding in waterstofchloride (HCl). Het waterstofatoom heeft één valentie-elektron, maar wil er twee hebben. Het chlooratoom heeft zeven valentie-elektronen, maar wil er acht hebben. Dit bereiken zij door een elektronenpaar te delen:
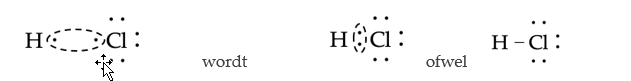
- Zoals men kan zien in de Lewisformule, heeft Cl nu acht stippen om zich heen, en H heeft er twee—zoals vereist door de octetregel. Merk op: de covalente binding wordt vaak geschreven als een streepje.
- Ammonia (NH3). Het stikstofatoom heeft vijf valentie-elektronen en wil dus drie covalente bindingen vormen.
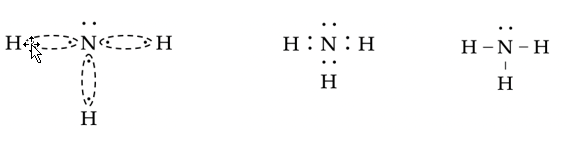
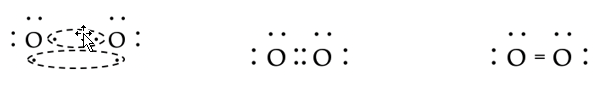
- Zuurstof (O2). Beide zuurstofatomen hebben zes valentie-elektronen en willen dus twee covalente bindingen vormen. Zij bereiken dit door twee paren elektronen te delen: een dubbele binding.