De basisregel voor de ruimtelijke structuur van moleculen is, dat valentie-elektronenparen elkaar afstoten. Het gaat hier zowel om bindingsparen als vrije elektronenparen. Het uitgangspunt is daarom de Lewisstructuur, waarin deze elektronenparen goed zichtbaar zijn.
Sterisch getal = in hoeveel verschillende richtingen er elektronenparen te vinden zijn.
sterisch getal = aantal atomen waarmee verbonden is + aantal vrije elektronenparen.
(Let op! Dubbele en drievoudige bindingen tellen in deze berekening als één binding.)
Aan de hand van het sterisch getal kan men nu een uitspraak doen over de ruimtelijke plaatsing van elektronenparen. In het bijzonder kan men de bindingshoeken van het molecuul schatten.
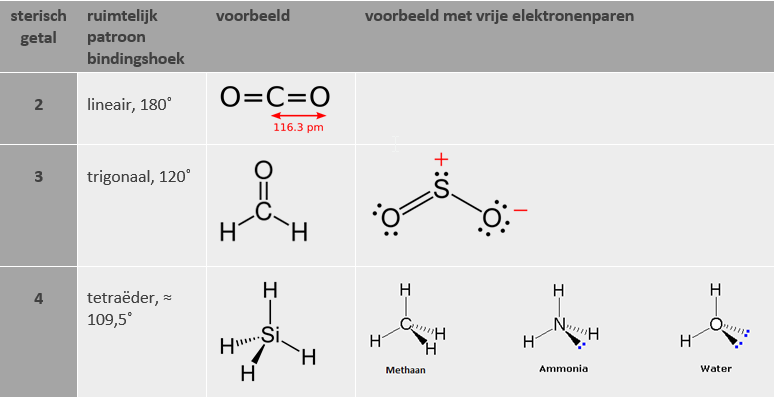
De gegeven bindingshoeken zijn slechts bij benadering. Vrije elektronenparen hebben een sterkere afstoting dan bindingsparen. Daarom is de bindingshoek in water bijvoorbeeld net iets minder dan 109,5˚, en de bindingshoek in SO2 net iets minder dan 120˚.
Sterische getallen groter dan 4 komen voor bij hypervalente atomen. Hiernaast is 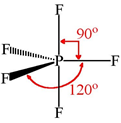 een voorbeeld te zien met sterisch getal 5.
een voorbeeld te zien met sterisch getal 5.
Voorbeeld: Schat de bindingshoek in het HCN-molecuul.
- Maak de Lewisstructuur. Een N-atoom maakt bij voorkeur drie
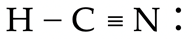 bindingen, dus teken we een drievoudige binding en een vrij elektronenpaar; een C-atoom maakt vier bindingen, dus nog een enkele binding naar H.
bindingen, dus teken we een drievoudige binding en een vrij elektronenpaar; een C-atoom maakt vier bindingen, dus nog een enkele binding naar H. - Het sterisch getal van het C-atoom is gelijk aan twee.
- Het molecuul is dus lineair, met een bindingshoek van 180˚.
