Als een stof uit moleculen bestaat, worden de atomen binnen het molecuul bij elkaar gehouden bij de zeer sterke covalente bindingen. Maar de moleculen zullen elkaar ook aantrekken, zij het veel minder sterk. Deze aantrekking heet intermoleculaire kracht.
- De vanderwaalskracht of London-dispersiekracht is een lichte aantrekking tussen alle atomen of moleculen, zelfs als zij ongeladen en niet-polair zijn. Dit is de enige kracht die een rol speelt in een edelgas zoals argon.
- De dipoolkracht is de aantrekking tussen moleculen die polair zijn. De δ+– en δ–-zijden van genabuurde moleculen trekken elkaar elektrisch aan. Een dergelijke kracht vindt men bijvoorbeeld in chloroform (CHCl3), waar de δ–-lading bij de chlooratomen de δ+-lading van het waterstofatoom aantrekt.
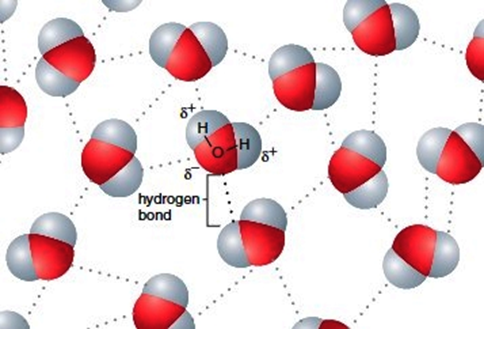
- Een waterstofbrug wordt gevormd tussen moleculen die een H–F, H–O of H–N binding bevatten. Het H-atoom krijgt een positieve lading, het andere atoom een negatieve lading. Doordat het verschil in elektronegativiteit zo groot is en de atomen klein zijn, krijgt men een veel sterkere aantrekking dan bij gewone dipoolkrachten.
- Het belangrijkste voorbeeld is water (zie afbeelding): zonder de waterstofbrug H…O zouden watermoleculen elkaar veel minder sterk aantrekken, en zou water bij kamertemperatuur gasvormig zijn.