Bij berekeningen van dichtheden in een mengsel is het nuttig een tabel te maken, met voor elke stof zowel het volume als de massa, en een rij voor de totalen. De dichtheid van het mengsel is gebaseerd op de totale massa en het totale volume. (We gaan er hierbij vanuit dat het volume van het mengsel gelijk is aan de som van de afzonderlijke volumes. Technisch gezien is dit niet altijd het geval: als men wat zout in water oplost, neemt het volume af!)
Voorbeeld: We mengen 300 g ethanol (dichtheid: 0,79 g/mL) met 250 mL water. Wat is de dichtheid van het mengsel?
- De tabel ziet er zo uit:
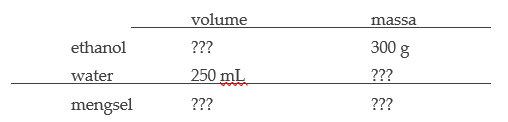
- We kennen de dichtheden van ethanol en van water (1,00 g/mL). Dit gebruiken we om de ontbrekende grootheden uit te rekenen.
$$\text{volume ethanol} = \frac{300 \; \text{g}}{0,79 \; \text{g/mL}} = 380 \; \text{mL}.$$ $$\text{massa water} = 250 \; \text{mL} \cdot (100 \; \text{g/mL}) = 250 \; \text{g}.$$
- We vullen deze waarden in de tabel in en berekenen de totalen.

- De dichtheid van het mengsel is dus
$$\text{dichtheid mengsel} = \frac{550 \; \text{g}}{630 \; \text{mL}} = 0,87 \; \text{g/mL}.$$
