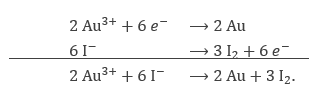Het is vaak nuttig om een redoxreactie te splitsen in twee half-reacties, die de oxidatie en reductie afzonderlijk beschrijven. In deze half-reacties worden de elektronen (e–) expliciet vermeld. In sommige gevallen (batterijen, elektrolyse) vinden deze half-reacties daadwerkelijk afzonderlijk plaats!
Bovenstaande reactie kan zo worden gesplitst in de half-reacties
(oxidatie) $\mathrm{Zn \rightarrow Zn^{2+} + 2} \; e^-$
(reductie) $\mathrm{2 H^+ + 2 }e^- \rightarrow \mathrm{H}_2$
Als half-reacties gegeven zijn, kan men deze combineren tot een volledige reactievergelijking. Als het aantal elektronen ongelijk is, vermenigvuldig dan eerst de half-vergelijkingen om deze gelijk te maken.
In een elektrochemische reactie vinden de volgende half-reacties plaats:
A: $\mathrm{Au^{3+} + 3} e ^- \rightarrow \mathrm{Au}$
B: $\mathrm{2 I^- \rightarrow I}_2 + 2 e^-$
Welke stof wordt geoxideerd? Schrijf de netto-reactievergelijking.
- Het jood wordt geoxideerd (vgl. B) omdat het elektronen verliest.
- Voor de netto-reactievergelijking vermenigvuldigen wij A met 2 en B met 3, zodat beide zes elektronen hebben. Tel ze vervolgens op.