In de koolstofchemie kan men niet toe met eenvoudige molecuulformules zoals C2H6O. Het is van het grootste belang de precieze structuur te kennen. In een structuurformule worden de atomen en bindingen afzonderlijk weergegeven.
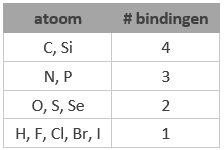
(Het is niet nodig om de gehele Lewisstructuur te tekenen; vrije elektronenparen worden meestal weggelaten. De atomen hebben vrijwel nooit een formele lading. Dus kunnen we toe met de vuistregels in nevenstaande tabel voor het aantal bindingen dat een atoom vormt.)
Structuurformules worden vaak afgekort.
- Atomen verbonden aan waterstof worden weergegeven als –CH2–, –CH3, –OH, enz. “Saaie” ketens van koolstof en waterstof kunnen nog verder afgekort, bijv. –C3H7.
- H-atomen die met koolstof verbonden zijn worden vaak geheel weggelaten.
- Daarnaast kan men het bindingsstreepje van C–H ook weglaten; de lezer kan namelijk zelf bedenken hoeveel H-atomen nodig zijn. De C-atomen worden dan ook niet getekend, zodat alleen de bindingen als lijnstukjes worden getoond.
Voorbeeld: Elk van deze formules beschrijft de stof 6-chloro-2-hexanone.
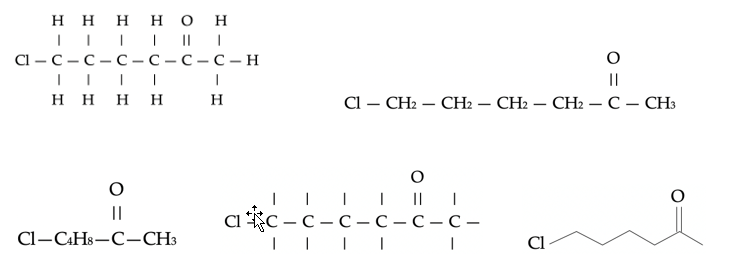
Naast de gangbare structuurformules zie je hier manieren om een structuurformule verkort op te schrijven: rechtsboven worden de structuren die met een enkele binding aan de C vastzitten niet apart getekend maar alleen genoteerd (CH2). Linksonder worden herhalende groepen van C-moleculen in één keer geschreven (C4H8). Daarnaast zijn de waterstofmoleculen niet apart getekend, maar alleen als een streepje weergegeven. Rechts onderin zie je de zaagtandnotatie: Elke hoek van de zaagtand stelt een CH2-groep voor. Als het een dubbele binding betreft, wordt er een dubbele streep getekend:
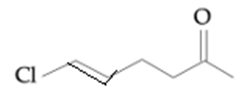
Deze stof is dus Cl – CH = CH – CH2 – CH2 – CO – CH3
