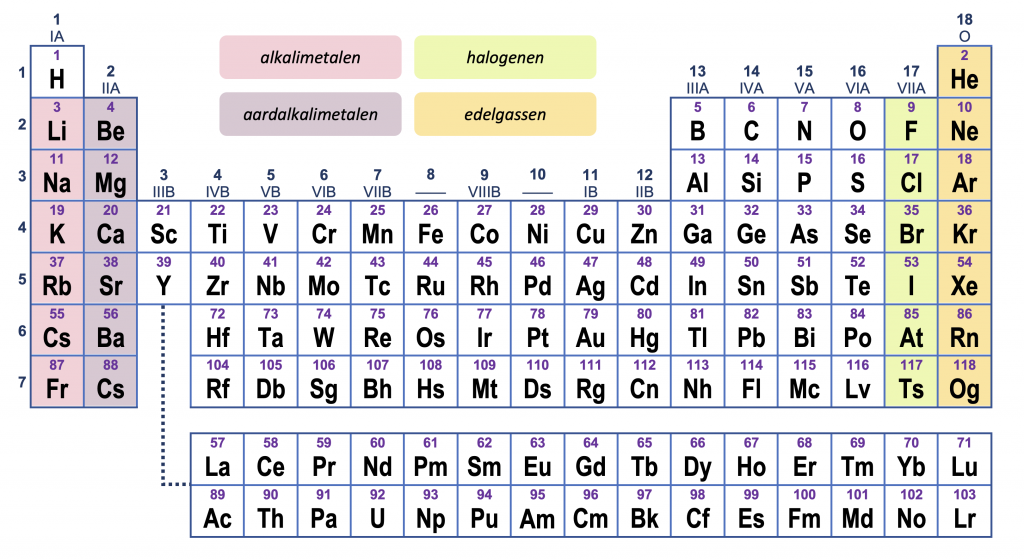
De naam “periodiek systeem” geeft aan, dat in de lijst van elementen bepaalde eigenschappen met regelmaat (periodiek) voorkomen. Elementen in dezelfde groep (kolom) hebben analoog chemisch gedrag. Een eenvoudig voorbeeld is groep 11 (IB): koper, zilver en goud zijn metalen die voor munten e.d. gebruikt worden omdat ze aantrekkelijk glanzen en niet gemakkelijk roesten.
Vooral bij de “A”-groepen (het s-blok en het p-blok) kan het periodiek gedrag worden verklaard aan de hand van valentie-elektronen. Fluor, chloor, broom en jood hebben analoog gedrag doordat ze allen 7 valentie-elektronen hebben.
| groep | valentie- elektronen | gedrag | voorbeelden |
|---|---|---|---|
| 1: alkalimetalen | 1 | ionlanding +1 reageren heftig met water, oxideren snel | natrium, kalium |
| 2: aardalkalimetalen | 2 | ionlading +2 reageren met stoom | magnesium, calcium |
| 17: halogenen | 7 | ionlading –1 reageren heftig met metalen (oxidanten) | chloor, broom |
| 18: edelgassen | 8 | vormt geen ionen niet of nauwelijks reactief zeer laag kookpunt | helium, argon |