Tijdens het verloop van een chemische reactie neemt de hoeveelheid reagens af, en de hoeveelheid product neemt toe. De reactiesnelheid beschrijft hoeveel van een stof er per seconde verdwijnt of ontstaat. Als X een reagens of product is in een reactie, dan is de bijbehorende (gemiddelde) reactiesnelheid
$$v_x = \frac{\Delta[\text{X}]}{\Delta t}.$$Het symbool [X] staat voor de concentratie van stof X in het reactiemengsel, in mol/L (M). ∆[X] is de toename in de concentratie van X, en ∆t is de tijd waarin dat gebeurt. De gebruikelijke eenheid voor de reactiesnelheid vX is mol/L.s.
De reactiesnelheid voor de reagentia en producten in een reactie zijn evenredig aan hun molverhouding. Voorbeeld: in $$\text{CH}_4 + 2 \; \text{O}_2 \rightarrow \; \text{CO}_2 + 2 \; \text{H}_2 \text{O}.$$
zal $v_{\text{H}2 O}$ altijd tweemaal zo hoog zijn als <$v_{\text{CO}2}$, omdat voor elk molecuul CO2 er twee moleculen H2O gevormd worden. De reactiesnelheden voor de reagentia, $v_{\text{CH}4}$ en $v_{\text{O}2}$ zijn negatief, omdat de hoeveelheid reagens in de loop van de tijd afneemt.
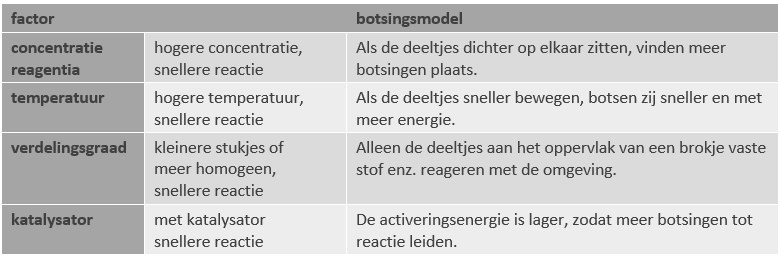
Men kan het verloop van de reactie in een grafiek weergeven: horizontaal is de tijd uitgezet, verticaal de concentratie. De reactiesnelheid komt nu overeen met het richtingsgetal (richtingscoëfficiënt, steilheid) van de grafiek. Uit het volgende voorbeeld is duidelijk dat de reactiesnelheid in de loop van de tijd tot nul afneemt: de grafieken lopen uiteindelijk horizontaal.
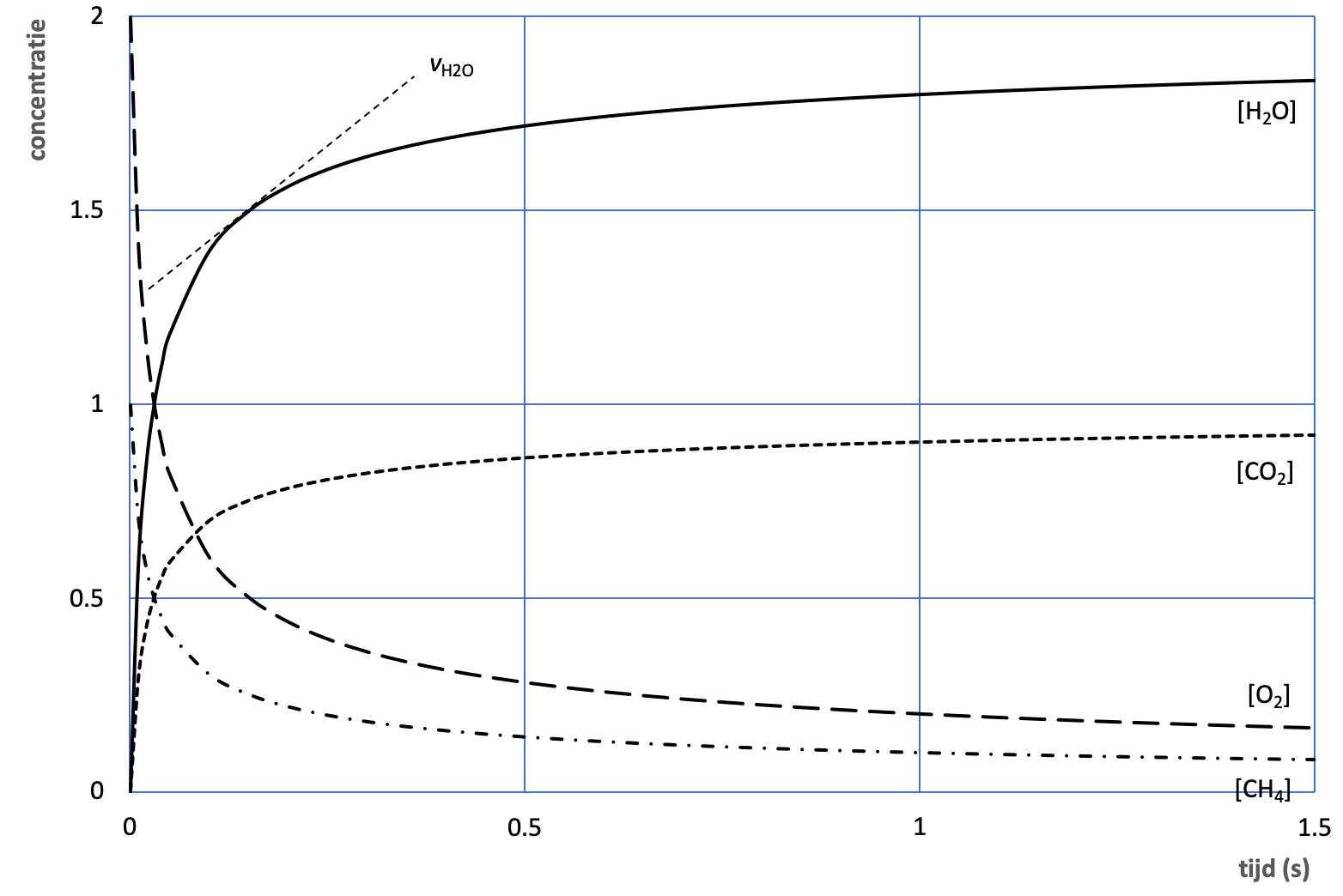
Om reactiesnelheid beter te begrijpen, kan men het botsingsmodel hanteren. In het reactiemengsel bewegen de deeltjes (moleculen, ionen) van de reagentia zich min of meer vrij. Een reactie vindt plaats wanneer de deeltjes met elkaar botsen, ze genoeg energie hebben, en de juiste oriëntatie hebben.
De volgende factoren bepalen de reactiesnelheid: