In het voorgaande werd besproken hoe men kan nagaan in welke richting de reactie zal verlopen op grond van de gegeven concentraties. Een vervolgvraag is: hoe groot zullen de concentraties zijn in evenwicht? Het antwoord hangt af van
- de beginconcentraties van de stoffen;
- de waarde van de evenwichtsconstante K.
In principe kan men hieruit de ligging van het evenwicht precies berekenen. Meestal is de wiskunde vrij lastig. Hier bespreken wij hoe, wanneer één van de evenwichtsconcentraties bekend is, de andere berekend kunnen worden.
Het is handig om een ICE-tabel (Initial, Change, Equilibrium) voor de boekhouding van de veranderingen die tijdens de reactie optreden.
- Schrijf de beginconcentraties in de eerste rij.
- Schrijf de bekende evenwichtconcentratie in de derde rij.
- Bereken de verandering (toename, afname) in de tweede rij.
- Gebruik molverhoudingen om alle andere veranderingen te bepalen.
- Bereken de ontbrekende evenwichtconcentraties.
Voorbeeld: Een vat bevat 0,30 mol/L H2-gas, 0,70 mol/L I2-gas en 0,80 mol/L HI-gas. Na enige tijd wordt evenwicht bereikt; er blijkt 0,08 mol/L H2-gas aanwezig te zijn. Bepaal de overige evenwichtconcentraties.
- De reactievergelijking is $\text{H}_2\; \text{(g)} + \text{I}_2 \; \text{(g)} \rightleftharpoons 2 \; \text{HI (g)}.$
- We schrijven de bekende waarden in een ICE-tabel.
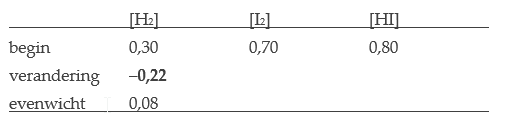
- De verandering in [H2] was 0,08 – 0,30 = –0,22 mol/L.
- Uit de molverhouding H2 : I2 : HI = 1 : 1 : 2 volgt, dat er eveneens 0,22 mol/L I2 verdwijnt, terwijl er 0,44 mol/L HI bijkomt:

